- Results
- Postmigratory CNCC segregation and lineage commitment during early tooth development
- Evolution and spatial separation of cellular domains in the mouse molar
- 出生后顶端乳头域保留二聚体前体细胞,这些细胞在小鼠磨牙发育中产生牙髓细胞(dental pulp)和成牙本细胞(odontoblasts)
- Different sets of genes switch on and off along the differentiation trajectory of the dental mesenchymal lineages during mouse molar development
- Cell–cell interaction between the cellular domains in the dental mesenchyme is important for lineage development in the mouse molar

Cranial neural crest细胞是脊椎动物为头颅面部发育和功能而进行的进化创新,然而,控制后迁移cranial neural crest细胞的细胞命运决策的机制仍然大多未知。我们以小鼠molar(臼齿)为模型,进行单细胞转录组分析,探究后迁移cranial neural crest细胞的细胞命运多样化。我们揭示了转录异质性的景观,并定义了在cranial neural crest细胞衍生的牙齿谱系多样化过程中specific cellular domains,并发现每个domain对不同的molar mesenchymal tissues(间充质组织)做出了特定贡献。此外,IGF信号介导的细胞间相互作用突显了dental mesenchyme(牙齿充质)自主调节的关键作用。重要的是,我们揭示了dental mesenchyme(牙齿充质)中特定于细胞类型的基因调控网络,并表明Foxp4对periodontal ligament(牙周膜)分化至关重要。我们的单细胞图谱提供了关于cranial neural crest细胞衍生odontogenic(牙源性)人群中细胞命运多样化过程的全面机制洞察。
Craniofacial(颅颜)结构是由各种细胞类型组成的高度复杂的组织。cranial neural crest cells(CNCCs)的建立是脊椎动物头部进化的关键步骤。CNCCs是一种独特的多能群体,能够产生vertebrate craniofacial(脊椎动物颅颜)复合体中的许多细胞类型,包括骨骼(bones)和软骨(cartilage)、牙齿(teeth)、颅神经节(cranial ganglia)、神经胶质细胞(glial cells)和色素细胞(pigment cells)。与trunk neural crest cells(躯干神经嵴细胞)不同,CNCCs在头部内部迁移,并在到达最终目的地后分化为不同的细胞类型。CNCCs迁移或分化缺陷会导致各种发育异常,如唇裂(cleft palate)和牙齿畸形(tooth malformation)。
尽管在过去几十年中积累了关于CNCC的广泛知识,但控制颅面形态发生过程中晚期CNCC命运决定的机制仍有待阐明。最近,一项对迁移前和迁移神经嵴细胞(NCCs)的单细胞研究表明,早期的NCCs经历了一系列连续的二元细胞命运决定,并且与主干神经嵴相比,当它们从神经管脱落时,CNCC对间充质命运有谱系偏见5。有趣的是,Zalc等人发现,CNCC前体通过重新激活多能性因子进行体内编程,以获得外胚层间充质命运。我们最近的研究表明,第一咽弓中的postmigratory CNCC经历动态的咽弓内运动,并在经历一系列分叉的命运决定时对多个谱系做出贡献。尽管如此,这些迁移后的CNCC在acquiring mesenchymal fate(获得间充质命运)后如何进一步多样化,并最终产生形成功能性成年组织的committed cell types(承诺细胞类型),目前尚不清楚。
基因调控网络(GRN)是细胞利用来管理复杂的时空发育程序的信息处理系统。William等人最近通过结合表观基因组和转录组分析方法描绘了早期CNCC的GRN。他们发现,包括顺式调控元件和转录因子在内的多个调控层面管理着神经嵴(neural crest)发生。然而,尽管我们对控制早期CNCC命运决策机制的认识有所进展,但关于后迁移CNCC如何获得细胞命运特异性程序的信息仍然有限。此外,单个细胞水平上后迁移CNCC的GRN仍然大部分未知。
牙齿是脊椎动物特有的器官,与其他外胚层器官(包括毛发和乳腺)类似,其发育涉及顺序(sequential)、相互作用的上皮-间充质相互作用。因此,对牙齿模型的研究提供了广泛适用的器官发生学见解。每颗牙齿可以在解剖上分为两个部分:冠部(crown)在胚胎阶段开始发育,根部则在出生后开始发育。牙齿的发育始于牙板(dental lamina),该牙板源自增厚的口腔上皮,并将向下凹到dental mesenchyme形成牙芽。然后,牙齿间充质会围绕着上皮牙芽浓缩,并通过芽、帽、钟和冠根转换阶段指导牙齿形态发生。 牙齿间充质组织来源于CNCCs,它们在迁移到第一咽弓的口腔区域后形成。
随后,它们分化为牙乳头(dental papilla)和囊谱系(follicle lineages)。 牙乳头细胞产生牙髓(dental pulp)和成牙本质细胞(odontoblasts),而牙囊(dental follicle)则分化为包括牙周韧带(periodontal ligament,PDL)、牙骨质(cementum)和牙槽骨(alveolar bone)在内的牙周组织。
因此,牙齿间充质的多能性使其成为研究后迁移CNCC谱系分化的优秀模型。此外,牙齿的解剖和发育阶段已经得到了很好的确定,进一步强调了牙齿作为研究后期CNCC理想模型的能力。体内牙齿间充质中的祖细胞高度异质性,并且最近评估了小鼠门齿和成年人牙齿的细胞异质性;然而,在单个细胞分辨率下揭示小鼠臼齿发育过程中转录异质性和基因调控网络(GRNs)的景观尚未被揭示。此外,在小鼠臼齿形成过程中控制细胞区域建立和谱系发展的机制仍不清楚。
在这项研究中,我们使用小鼠臼齿作为模型,探究了控制后CNCC命运决策的细胞异质性和基因调控网络(GRNs)。我们在小鼠臼齿的几个关键发育阶段对单个细胞进行了转录组分析,并确定了从胚胎到出生后阶段小鼠臼齿发育过程中牙髓间充质内部的细胞异质性景观。
我们通过在牙髓间充质中新发现的标志基因定义了细胞区域,并发现每个区域对小鼠臼齿形成做出了特定的贡献。
此外,我们研究了牙髓间充质中的细胞-细胞相互作用,并发现IGF信号介导的细胞-细胞相互作用紊乱会影响PDL发育,突显出对于后迁移CNCCs而言,细胞自主调节的重要性。重要的是,我们在牙髓间充质中确定了特定于不同细胞群体的调控元件,并发现关键调控元件Foxp4的丧失会导致PDL谱系的发育缺陷。因此,这个单细胞图谱揭示了发育中的臼齿间充质内部之前未知的异质性,并提供了关于在臼齿形态发生过程中控制CNCC衍生细胞谱系分化的机制的全面理解。
Results
Postmigratory CNCC segregation and lineage commitment during early tooth development
迁移后的CNCCs在到达第一咽弓的口腔区域后,会致力于成为牙齿间充质细胞系。接下来,这些组织通过一系列的发育阶段进一步分化,直到牙齿萌出。为了全面揭示小鼠molar发育过程中,迁移后的CNCCs的细胞异质性和功能,我们对 E13.5 至 P7.5 牙齿及其周围组织中的个体细胞转录组进行了测序(图1a)。

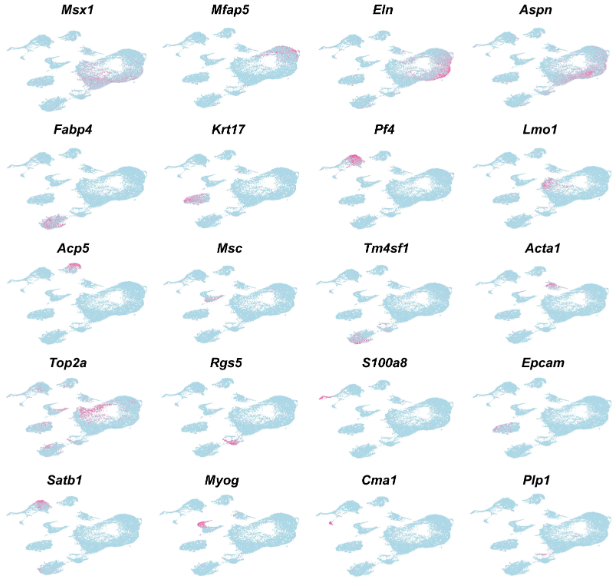
我们首先对 E13.5 的细胞群进行了分析,这是牙齿发育的开始阶段。通过无监督聚类和标记分析,我们鉴定出一个大型CNCC衍生的细胞群,包括软骨细胞(chondrogenic cells)、成骨细胞(osteogenic cells)、皮肤纤维母细胞(dermal fibroblasts)和牙间质细胞(dental mesenchyme)(补充图1a-c)。


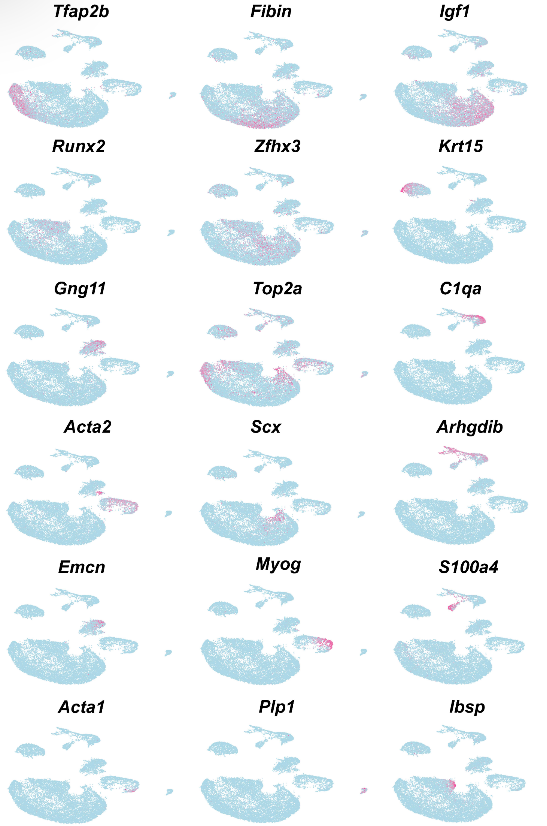
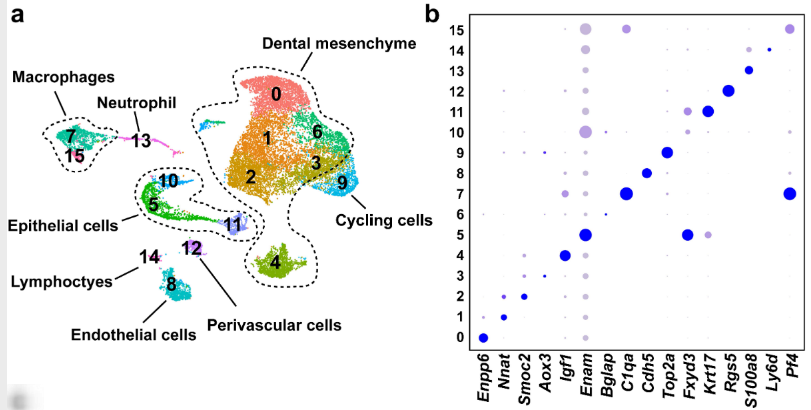
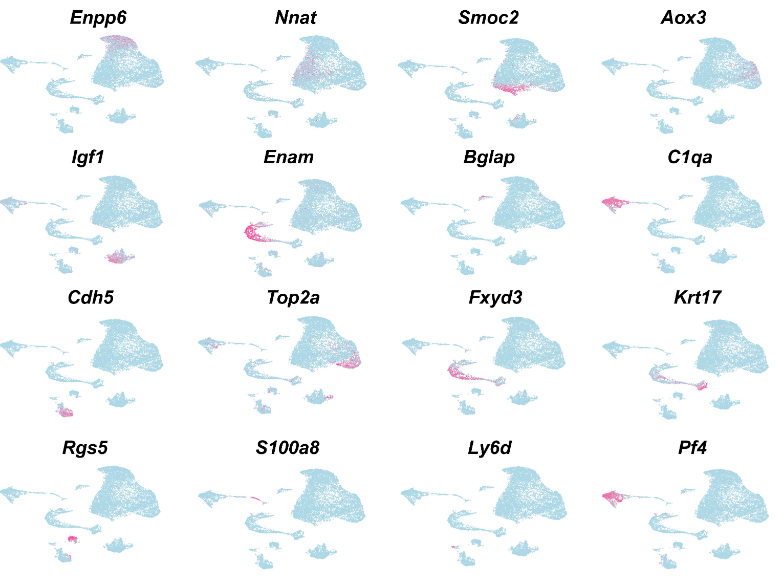
图1 小鼠molar及其周围组织中E13.5的细胞群。a 显示小鼠molar及其周围组织E13.5时的细胞类型UMAP图。根据细胞类型特异性标记基因的表达进行注释。b 显示a中细胞群中的标记基因的散点图。c 显示b中标记基因的特征图。
通过对已知早期牙间质标记物Tfap2b进行进一步的细胞亚群聚类分析,发现一个细胞群(Tfap2b+/Lhx6+)被鉴定为E13.5的牙间质(图1b)
这表明在迁移后的CNCCs于E13.5时期承担了牙齿的命运,牙间质细胞具有相对较高的同质性。与标记分析一致,这些标记基因的RNAscope原位染色显示它们在围绕牙上皮的牙间质中表达(图1c-f)。
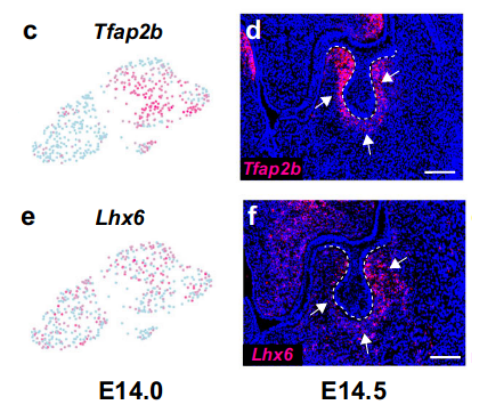
c-f 特征图和RNAscope染色显示Tfap2b和Lhx6在E13.5小鼠臼齿中的表达情况(n=3)。
在小鼠molar E13.5时的牙间质细胞域如图1g所示。
为了确认我们在E13.5鉴定的这个细胞群是贡献于牙齿形成的祖细胞群,我们使用Lhx6CreER^{T2};tdT小鼠进行了谱系示踪实验。Tamoxifen在E12.5注射以激活CreER^{T2},并且我们验证了Lhx6+细胞在E14.0时存在于牙间质中(图1h)。我们发现,Lhx6+细胞可以产生牙间质中的所有祖细胞系,在P21.5时(图1i-m),这表明E13.5时的Lhx6+细胞群确实是贡献于牙齿形成的牙间质祖细胞群。

使用Lhx6-CreERT2;tdT小鼠恒定追踪实验的molar牙齿(n = 3)。注射方案在图像下方说明。d,f,h,i和j中的白色虚线轮廓了小鼠molar的牙齿上皮细胞,在l和m中轮廓了PDL。白色箭头指向阳性信号。比例尺为100μm。
为了询问牙髓间充质细胞的谱系发育,我们进一步分析了E14.5小鼠臼齿中的细胞群体。利用已知的牙髓间充质标记物Tfap2b和Pax9,在帽阶段,我们能够更具体地确定这个阶段的牙髓间充质细胞群体(图2a、b和补充图2a-c)。
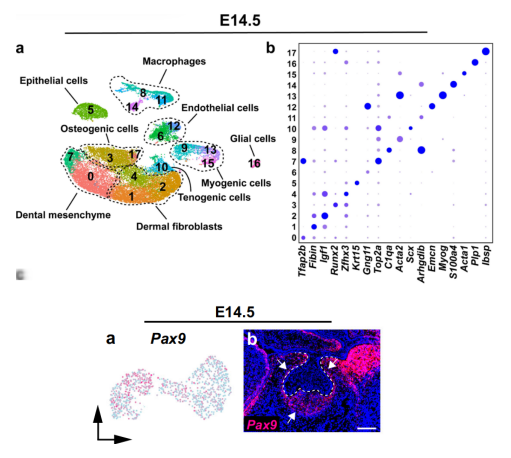
与以前的研究一致,我们发现Pax9在E14.5时既表达于牙囊又表达于牙乳头。为了确认E14.5小鼠臼齿中的Pax9+细胞是牙髓间充质祖细胞,我们进行了Pax9-CreERT2;tdT小鼠的谱系追踪实验,并在E13.5时使用tamoxifen诱导。结果清楚地显示,Pax9+细胞位于E14.5时期的牙髓间充质中,并且它们确实是祖细胞,因为它们可以产生小鼠臼齿中所有的间充质谱系(图2c-f)。

通过对Pax9+细胞的亚聚类分析,我们发现Pax9+细胞有两个明显分离的簇,对应于牙囊(dental follicle)和牙乳头(dental papilla)细胞群体,表明这两个谱系在E14.5时分离(图2g和补充图3a-f)。


我们确定了这两个细胞群体中富集的顶级基因,并通过无偏标记分析找到了这两个谱系的以前未知的独特标记(图2h、i)。
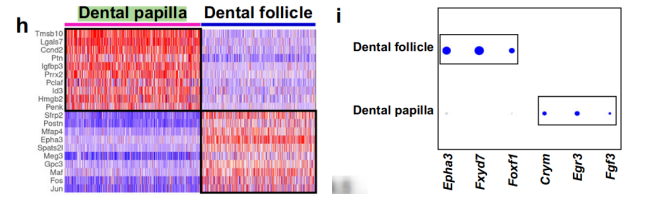
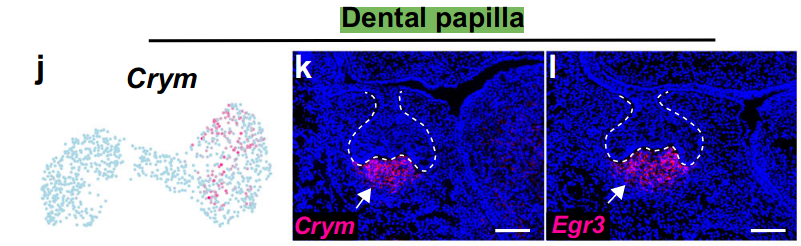
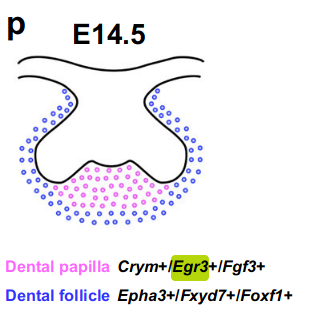
通过RNAscope原位染色,我们发现牙乳头(dental papilla)标记基因(Crym+/Egr3+/Fgf3+)仅在牙乳头中特异性表达,并且不在牙囊中表达(图2j-l和补充图3a-c)。
相反,我们发现牙囊(dental follicle)标记基因(Epha3+/Fxyd7+/Foxf1+)在包围着牙齿上皮(dental epithelium)和牙乳头(dental papilla)的牙囊(dental follicle)细胞区域中表达(图2m-o和补充图3d-f)。

小鼠molar在E14.5时的这两个不同细胞区域——牙乳头和牙囊——如图2p所示。
Evolution and spatial separation of cellular domains in the mouse molar
在E16.5时,小鼠臼齿达到钟乳阶段,冠部图案得以确定。通过亚聚类和无监督标记物分析,我们能够在E16.5的牙髓间充质中确定四个细胞群体(图3a、补充图4a-c和补充图5a-l)。

这些细胞群体之间有不同的特征基因(图3b、c)。

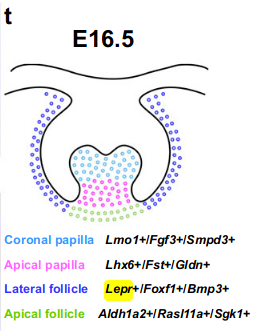
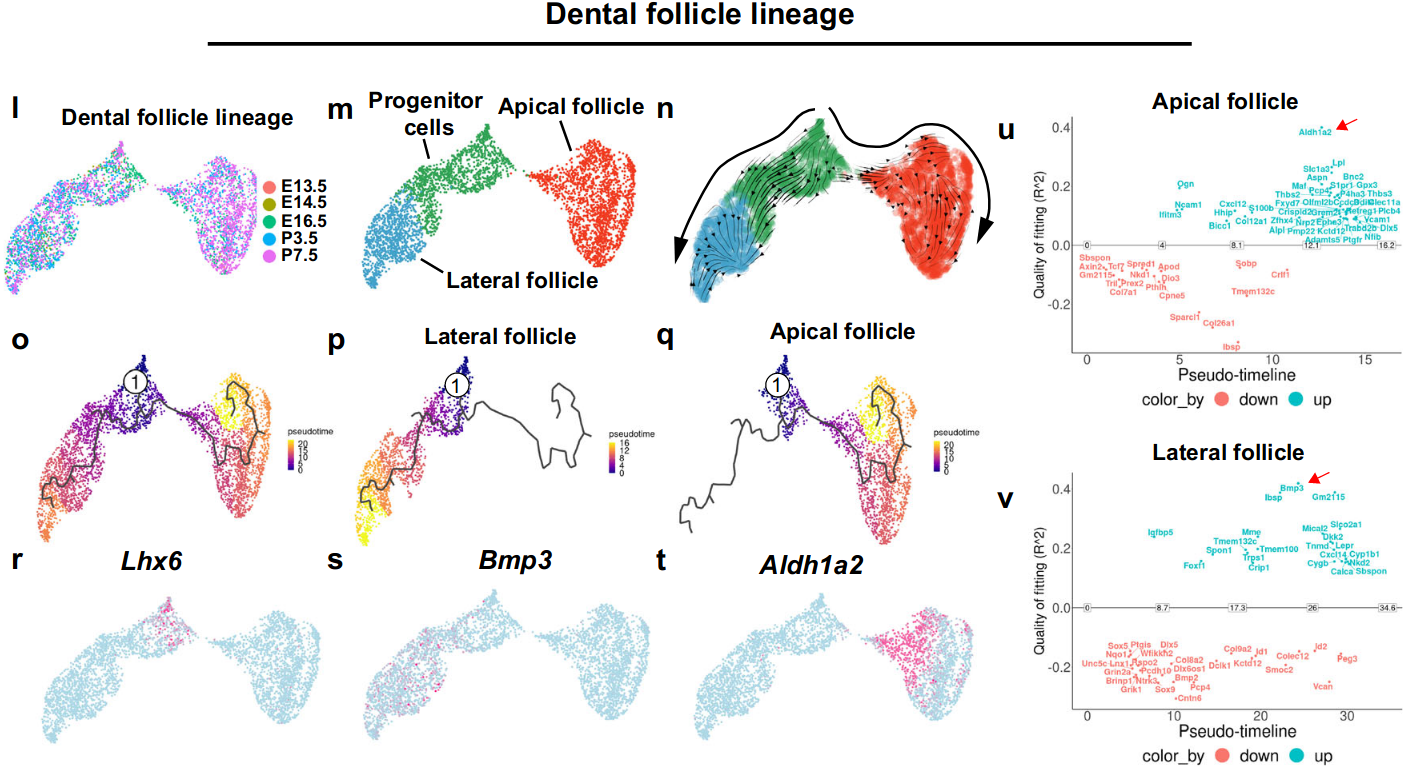
在这个阶段,牙乳头细胞群体已经形成了分离的冠部(Lmo1+/Fgf3+/Smpd3+)和顶端域(Lhx6+/Fst+/Gldn+)(图3d-i和补充图5a-f),与E14.5相比,这是牙乳头谱系进一步分化的反映。同样地,牙囊细胞也演化成了两个细胞域,分别位于牙囊的侧面(Lepr+/Foxf1+/Bmp3+)和顶端区域(Aldh1a2+/Rasl11a+/Sgk1+)(图3j-o和补充图5g-l),表明它们对于牙齿内空间不同区域的发育做出了贡献。
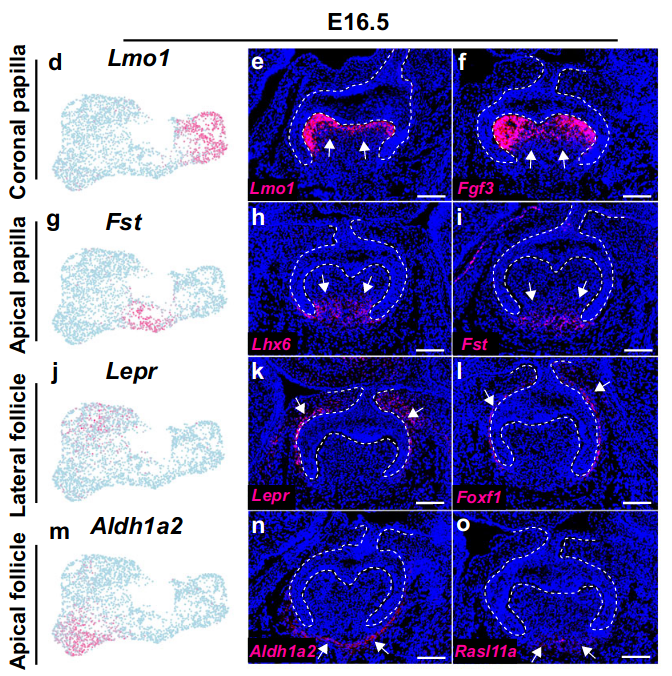
为了验证牙囊细胞群体的贡献,我们生成了LeprCre;tdT小鼠,以研究Lepr+侧面囊细胞在小鼠臼齿发育中的贡献。据报道,Lepr+细胞是长骨中的骨髓间充质(bone marrow mesenchymal)干细胞。我们发现,在牙囊中的Lepr+细胞可以产生包括PDL(牙周韧带)和牙槽骨(alveolar bone)在内的周围组织,但这些细胞在小鼠臼齿根部区域由牙乳头衍生的牙髓和成牙细胞中是不存在的,这表明Lepr+细胞确实是牙囊祖细胞,对小鼠臼齿周围组织的发育做出了贡献(图3p-s)。

小鼠臼齿E16.5时期的牙乳头和牙囊的细胞域如图3t所示。
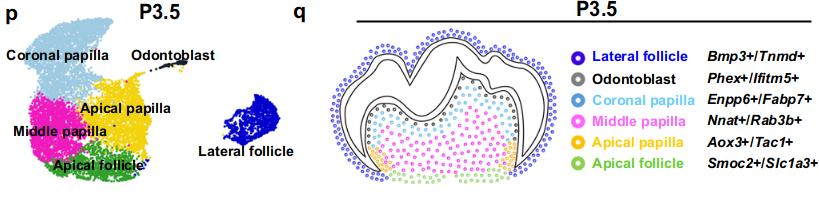
为了更好地理解小鼠臼齿根发育过程中的细胞异质性和牙间充质细胞的作用,我们从P3.5的臼齿中分离出细胞,此时根发育即将开始。根据P3.5时无监督聚类和新鉴定的特征基因分析,将6个细胞群体归为牙间充质组织(图4a-c和补充图6)。

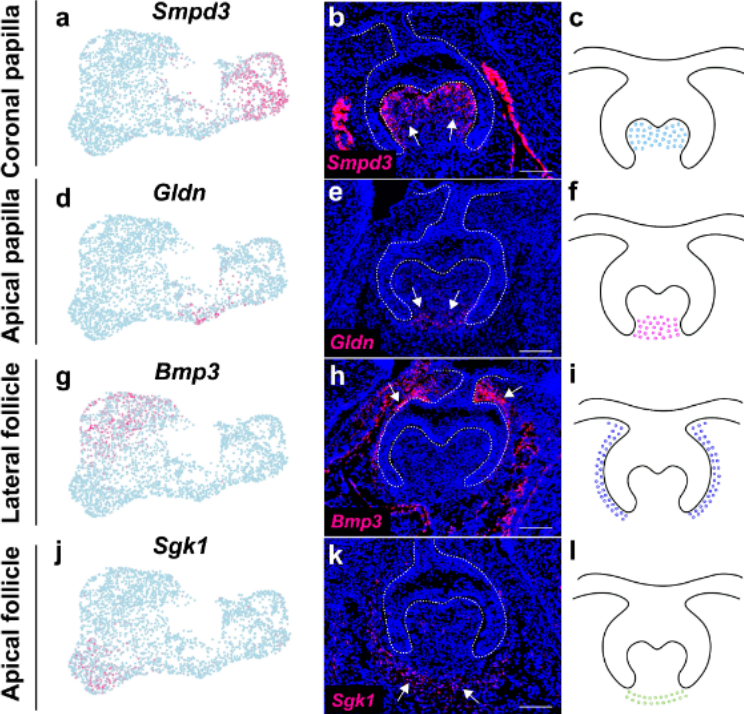
基于这些新鉴定的特征基因在P3.5时的表达模式,定义了一个侧方囊区(lateral follicle domain)(Bmp3+/Tnmd+)和一个顶端囊区(apical follicle domain)(Smoc2+/Slc1a3+)(图4d-k)。

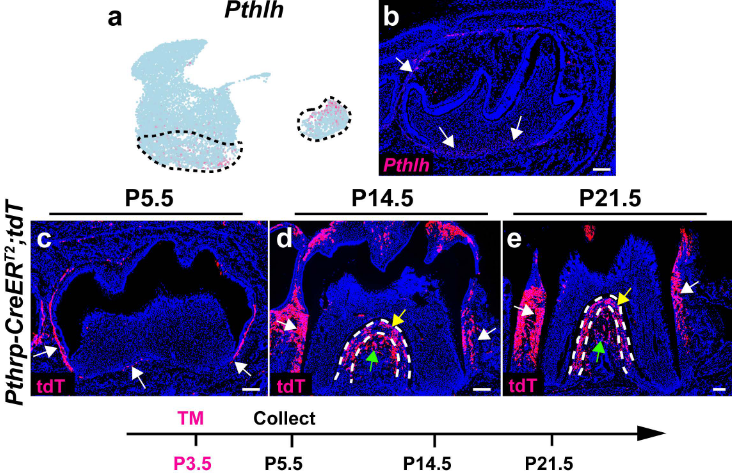
囊(follicle)区模式与E16.5观察到的相似,表明牙囊中的细胞区域已经在E16.5时建立。为了检测牙毛囊细胞在P3.5对牙根发育的贡献,我们首先分析了Pthlh(编码Pthrp的基因)的表达情况,这是小鼠臼齿牙囊的已知标记,并确认其在侧方(lateral)和顶端(apical)囊区均有表达(补充图7a,b)。为了验证Pthrp+细胞的贡献,我们进行了一项谱系追踪实验,使用Pthrp-CreERT2;tdT小鼠。在P3.5时注射他莫昔芬以启动CreERT2,并与其表达模式一致,我们发现在他莫昔芬诱导后两天,在牙囊的侧方和顶端区域均有Pthrp+细胞(补充图7c)。我们还揭示了Pthrp+细胞可以产生小鼠臼齿分叉和根形成区域的牙周组织(补充图7d,e)。
为了进一步了解牙囊(dental follicle)中顶端(apical)区域的贡献,我们生成了Slc1a3-CreERT2;tdT小鼠以针对顶端囊(apical follicle)区,并进行谱系追踪。Slc1a3是神经系统中星形胶质细胞的已知标记。细胞谱系追踪数据显示,在他莫昔芬诱导后两天,Slc1a3+细胞位于牙囊(dental follicle)的顶端区域,并且它们在小鼠臼齿的两个根分离处(图4m-o)大量贡献于牙周韧带(PDL)和牙槽骨(alveolar bone)的形成,这表明牙囊中顶端区域的细胞主导了根分叉发育的细胞谱系。

基于特征基因表达和谱系追踪数据的分析(图4d-p和补充图8),图4q展示了P3.5时牙间充质组织的细胞区域。

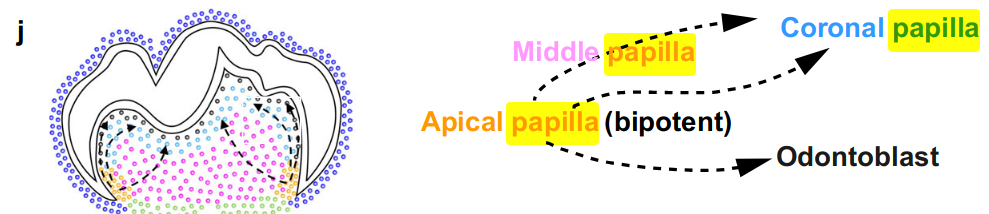
出生后顶端乳头域保留二聚体前体细胞,这些细胞在小鼠磨牙发育中产生牙髓细胞(dental pulp)和成牙本细胞(odontoblasts)
在分析来源于CNCC的牙乳头内的细胞异质性时,我们通过无监督标记分析在P3.5小鼠磨牙的牙乳头中鉴定了四个具有新鉴定的标记基因的细胞结构域。成牙本质细胞(odontoblasts)(Phex+/Ifitm5+)是位于小鼠磨牙牙本质(dentin)下方的终末分化的牙本质形成细胞(dentin-forming cells)(补充图第8a-d段)。冠状牙乳头(dental papilla)(Enpp6+/Fabp7+)、中间牙乳头(middle dental papilla)(Nnat+/Rab3b+)和顶端牙乳头(apical dental papilla)(Aox3+/Tac1+)内的细胞群是具有不同分化状态的牙乳头细胞(补充图第8e–p段)。
为了了解这些细胞群在牙乳头中的分化轨迹,我们利用了Velocity分析,该分析基于剪接和未剪接的mRNA的比例推断细胞的分化状态。结果表明,根尖牙乳头细胞是可以产生成牙本质细胞(odontoblasts)和牙髓(dental pulp)谱系的祖细胞(图5a)。

P3.5时小鼠磨牙中牙乳头细胞群的速度分析
由于高增殖细胞位于小鼠磨牙牙乳头的顶端区域(图5b,c),为了确认体内的分化轨迹,我们首先通过EdU追踪实验检查了EdU+循环细胞是否有助于牙髓和成牙本质细胞的形成。结果表明,在追踪9天后,根尖牙乳头结构域内的EdU+细胞确实会产生成牙本质细胞和牙髓谱系(图5d,e)。
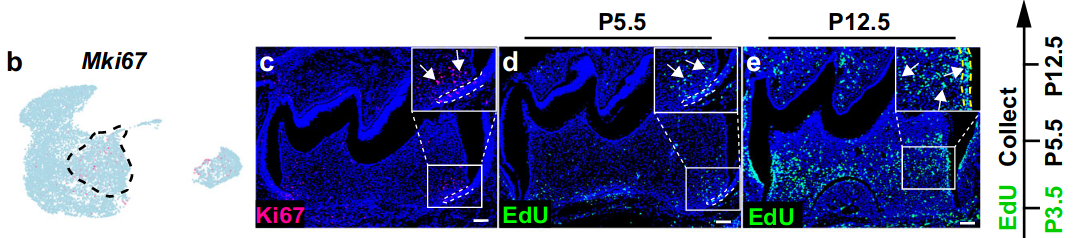
此外,我们发现编码FGF信号配体的Fgf3在P3.5的根尖牙乳头中特异性表达(图5f,g)。

为了确认根尖乳头中的Fgf3+细胞是否是牙髓(dental pulp)和成牙本质细胞(odontoblast)形成的祖细胞,我们产生了Fgf3CreERT2;tdT小鼠,从而能够在P3.5时追踪小鼠磨牙中的Fgf3+细胞。结果表明,根尖乳头中的Fgf3+细胞可以成为牙髓细胞和成牙本质细胞(图5h,i),这表明根尖乳头细胞是在小鼠磨牙中产生牙髓(pulp)和成齿本质细胞(odontoblast)谱系的双能祖细胞(图5j)。据报道,冠状区的牙髓细胞在损伤后修复过程中形成成牙本质细胞28,29,这表明调节牙乳头祖细胞分化轨迹的机制在发育和修复过程中是不同的。
Different sets of genes switch on and off along the differentiation trajectory of the dental mesenchymal lineages during mouse molar development
为了研究牙根发育的细胞结构域是否在P3.5时完全发育,我们进一步分析了P7.5时小鼠臼齿中的细胞群,发现该阶段牙齿间充质中的细胞结构和相应的特征基因与P3.5时的相似(补充图9),表明用于牙根形成的细胞结构域是在P3.5处建立的。

为了了解在小鼠磨牙发育过程中决定细胞命运的遗传程序的细微变化,我们首先使用Seurat 4对上述五个发育阶段(E13.5、E14.5、E16.5、P3.5、P7.5)的牙乳头谱系单细胞RNA-seq数据进行了综合分析。我们根据其高度特异性的标记基因鉴定了可分为牙髓和成牙本质细胞谱系的细胞群体(图6a,b)。

为了研究牙乳头谱系的发展,我们首先使用scVelo进行Velocity25。我们发现,与我们的体内发现一致,常见的祖细胞分为两个主要分支,对应于上述牙髓和成牙本质细胞谱系(图6c)。

然后进行Monocle 3伪时间分析,该分析提供了牙乳头细胞命运决定的计算模型,以证实这一发现(图6d–i)。
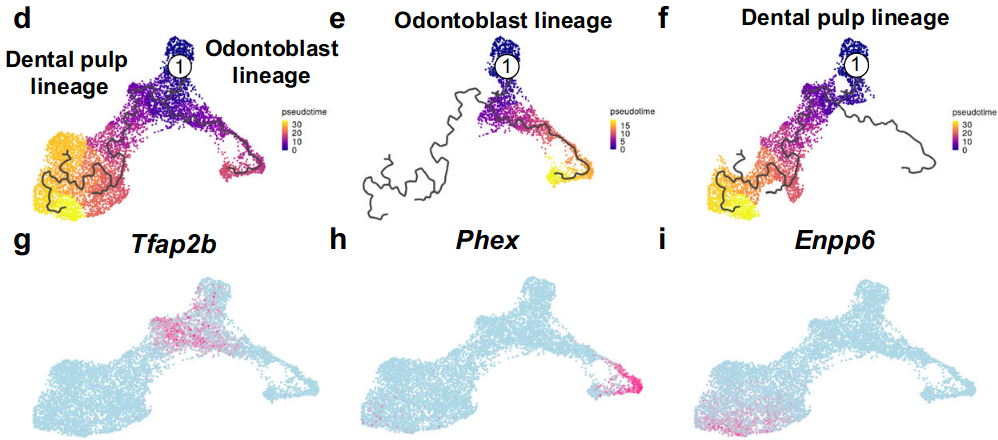
本研究中发现的最早的牙齿间充质标志物Tfap2b在假时间分析中被用来指代根结。为了进一步了解牙乳头中祖细胞的细胞命运转变,我们进行了基因开关分析,通过该分析,我们确定了在特定谱系中开关的基因组。有趣的是,在每个谱系中鉴定的许多标记基因在这些特定谱系中被“开启”,这为小鼠磨牙形成过程中的细胞谱系发育提供了另一层证据(图6j,k)。

同样,我们对牙毛囊谱系进行了类似的分析,与我们在体内发现的结果一致,祖细胞沿着分化轨迹在顶端和侧面毛囊中产生细胞群(图6l–t)。在牙毛囊谱系发育的过程中,还发现不同的基因组被打开/关闭,这突出了控制牙间充质中祖细胞命运转变的遗传程序的动态变化(图6u,v)。
Cell–cell interaction between the cellular domains in the dental mesenchyme is important for lineage development in the mouse molar
为了深入了解牙齿间充质中不同细胞结构域之间的潜在信号相互作用,我们选择分析P3.5中的数据集作为代表。我们使用CellChat软件包询问了我们的数据,该软件包能够以单细胞分辨率预测配体和受体的相互作用。P3.5细胞结构域之间的多向信号相互作用如图7a所示,突出了牙齿间充质细胞群体之间复杂的相互作用。

为了进一步阐明相互作用模式,我们分析了传出和传入信号模式,数据表明每个细胞结构域都是不同信号配体的来源(图7b和补充图10)。
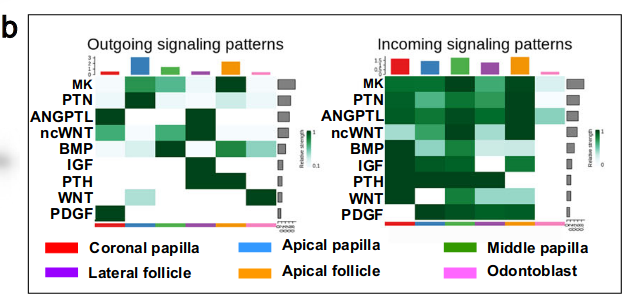


例如,根尖乳头(apical papilla)和成牙本质细胞(odontoblasts)分泌Wnt10a,这是一种典型的经典WNT配体。先前的研究表明,牙齿间充质中典型WNT信号的缺失会导致牙根发育缺陷。中乳头和顶端毛囊是Bmp2的来源,我们之前已经表明,牙根祖细胞中BMP信号的破坏导致牙根形成的缺失。
IGF信号传导被预测为介导外侧卵泡(lateral follicle)细胞和其他细胞结构域之间的相互作用(图7b)。为了验证IGF配体的表达模式,在P3.5的小鼠磨牙中进行Igf1和Igf2的RNAscope原位染色。数据显示,Igf1在牙毛囊中特异性表达,而Igf2的表达在牙间充质中几乎检测不到。Igf1r在小鼠磨牙中广泛表达,这表明牙毛囊是Igf配体的来源,通过Igf1r激活牙间充质细胞结构域中的IGF信号传导(图7c–h)。

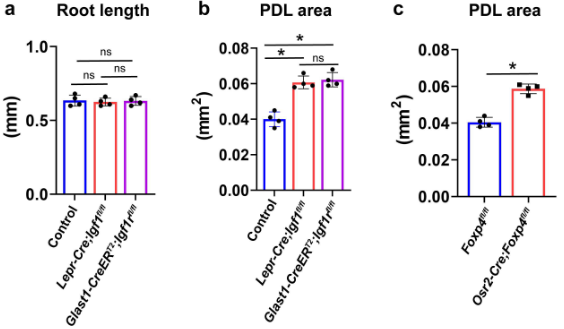
为了测试IGF信号介导的细胞-细胞相互作用在牙齿间充质中的功能,我们产生了Lepr-Cre;Igf1fl/fl和Slc1a3-CreERT2;Igf1rfl/fl小鼠模型,其中Igf1和Igf1r分别在小鼠磨牙的侧卵泡和顶端卵泡中缺失。我们发现Igf1或Igf1r的缺失对小鼠磨牙的根长度没有明显影响,而在P16.5时,两个突变体的PDL面积都比对照大,这表明突变体中PDL的状态相对未分化(补充图11a,b)。
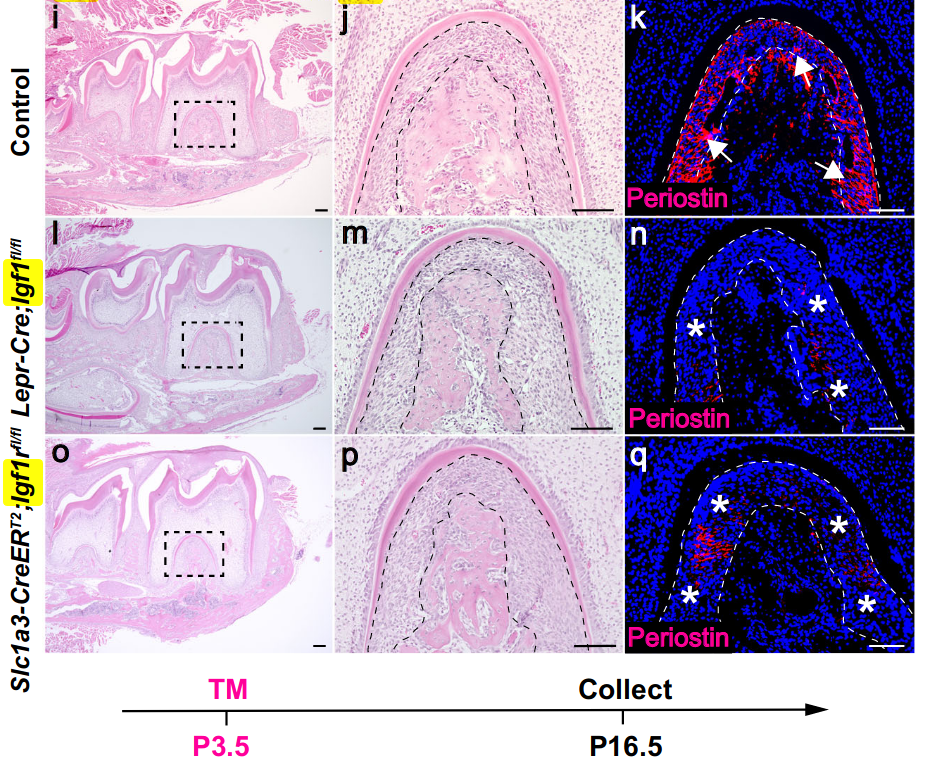
两种突变模型中受损的PDL分化通过periostin的表达减少得到了进一步证实,periostin是PDL分化的标志物(图7i–q),表明Igf1-Igf1r介导的外侧和顶端毛囊结构域之间的细胞-细胞相互作用对PDL的发展很重要。
Gene regulatory networks determine the lineage development in the dental mesenchyme during mouse molar morphogenesis
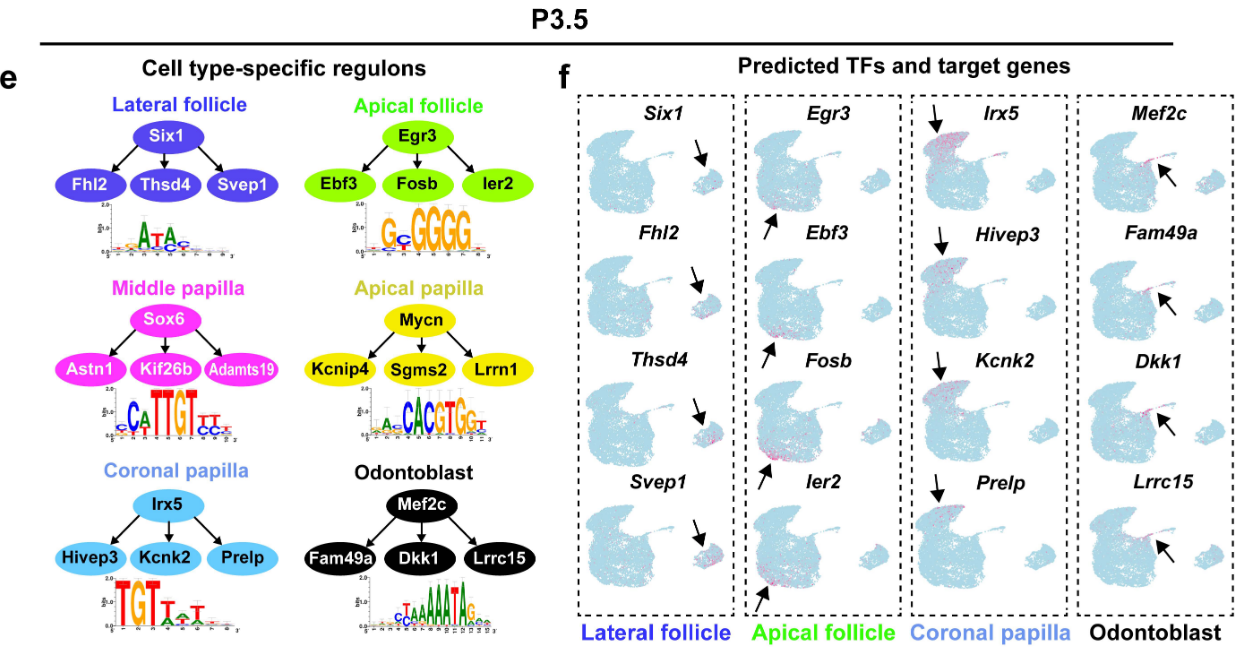
GRN在控制细胞命运指定和分化方面发挥关键作用。为了揭示控制牙间充质谱系发育的机制,我们应用SCENIC工作流程来识别细胞类型特异性调节子,以全面重建牙间充细胞中的GRN(图8a).

调节子、转录因子、T、靶基因的示意图。
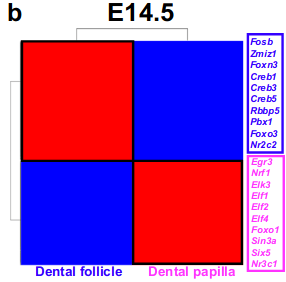
当牙乳头和毛囊谱系分离时,我们首先在E14.5识别了牙间充中的细胞类型特异性调节子(图8b)。
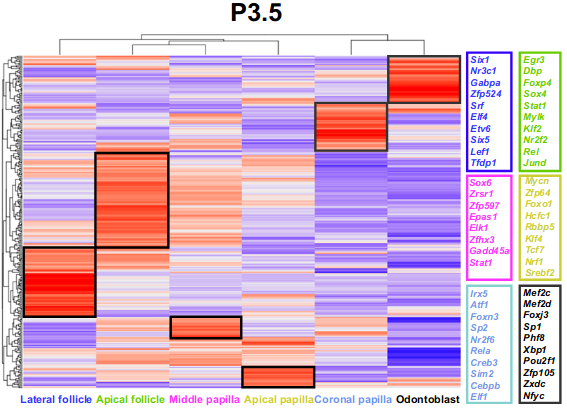
E14.5、E16.5和P3.5处牙齿间充质细胞群中细胞类型特异性调节子和选定的顶部富集调节子的热图。
我们发现几个转录因子家族参与了这两个不同的谱系。例如,包括Creb1、Creb3和Creb5的Creb家族成员与牙毛囊相关,而Elf家族成员如Elf1、Elf2和Elf4与牙乳头相关。E14.5中突出显示的调节子显示,预测的转录因子(TF)和相应的靶基因在同一细胞结构域中表达,这表明在牙乳头和毛囊中富集的GRN对于这些群体的细胞命运决定是独特和重要的(补充图12a,b)。

为了研究在E16.5时维持小鼠磨牙中牙间充质细胞群身份的机制,我们在该阶段对牙间质进行了调节子分析(图8c)。

我们发现,与先前的发现一致,几个转录因子家族,如Dlx家族成员Dlx2和Dlx5,在牙乳头细胞群中高度富集,而Klf家族成员,如Klf4和Klf11在牙毛囊群体中高度富集。共表达的TF和靶基因揭示的GRN表明,它们参与调节E16.5小鼠磨牙中的牙间充质谱系发育(补充图12c,d)。

为了揭示GRNs在臼齿根形成过程中调节细胞谱系发育的功能,我们在P3.5数据集上使用SCENIC管道进行了调节子分析,并鉴定了牙齿间充质中的细胞类型特异性调节子,这些调节子对维持P3.5时磨牙间充质的细胞同一性和驱动细胞异质性可能很重要(图8d和补充图12e,f)。特别地,FOX(forkhead box)成员,如Foxp4、Foxn3和Foxj3,在P3.5的小鼠磨牙的细胞结构域中高度富集,表明FOX转录因子广泛参与P3.5的牙间充质细胞的调节。这与FOX转录因子超家族在组织发育和稳态中的重要性一致。
与标记物分析一致,Foxp4在P3.5的磨牙牙乳头和毛囊中均表达(图8e,f)。
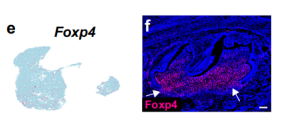
为了验证 Foxp4 在牙齿发育中的功能,我们构建了 Osr2-Cre;Foxp4fl/fl 小鼠,该小鼠的牙齿间充质中 Foxp4 被缺失。我们发现,尽管对照组和 Osr2-Cre;Foxp4fl/fl 小鼠的磨牙牙根长度无明显差异 (图 8g-i),Osr2-Cre;Foxp4fl/fl 小鼠的牙周膜面积较大,且牙周素表达减少,特别是在牙根分叉区域 (图 8j-o 和 Supplementary 图 11c),这表明 Foxp4 在磨牙牙根发育中调节牙周膜分化,并且牙囊 mesenchyme 中重构的 GRNs 在小鼠磨牙形态发生中具有重要的功能,从而决定了牙齿 lineage 的发展。
- 为了确认我们在E13.5鉴定的这个细胞群是贡献于牙齿形成的祖细胞群(Lhx6+)
- 为了确认E14.5小鼠臼齿中的Pax9+细胞是牙髓间充质祖细胞
- 通过对Pax9+细胞的亚聚类分析,我们发现Pax9+细胞有两个明显分离的簇,对应于牙囊(dental follicle)和牙乳头(dental papilla)细胞群体,表明这两个谱系在E14.5时分离
- 牙囊中的Lepr+细胞可以产生包括PDL(牙周韧带)和牙槽骨(alveolar bone)在内的周围组织,但这些细胞在小鼠臼齿根部区域由牙乳头衍生的牙髓和成牙细胞中是不存在的,这表明Lepr+细胞确实是牙囊祖细胞
牙乳头标记基因(Crym+/Egr3+/Fgf3+)仅在牙乳头中特异性表达
表明牙囊中的细胞区域已经在E16.5时建立
小鼠臼齿牙囊的已知标记Pthlh
我们利用了Velocity分析,该分析基于剪接和未剪接的mRNA的比例推断细胞的分化状态。